内分泌かく乱作用とその試験法
1. はじめに
1-1 ホルモンの生体内挙動
生体は、1つ1つの細胞から形成された集団であり、それらの細胞が組織や器官を形成して、1つの生命体となります。個々の細胞から構成される組織や器 官が、1つの生命体として秩序ある状態を維持できるのは、各細胞や組織・器官(系)の間で情報伝達を行い、協調し合う仕組みが多く存在するからです。生体 の機能を正常に保とうとする働きを恒常性(ホメオスタシス)といいますが、内分泌系や神経系等の仕組みは、ホメオスタシスの維持において主要な役割を果たしています。
内分泌系は、ホルモンとよばれる情報伝達物質を、体液を媒体として各器官に届けることにより情報伝達しています。内分泌系を構成し、ホルモンを産生する器官には、下垂体、甲状腺、副腎、生殖器等があります。
ここでは、生殖内分泌系を例にして、各器官とホルモンとの関係を述べます。
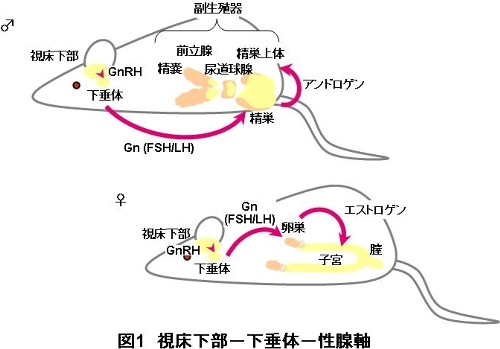
生体は、外界から光や接触等の刺激を受けると間脳の視床下部から性腺刺激ホルモン放出ホルモン(GnRH)というホルモンを放出します。GnRHは、 下垂体に到達し、黄体形成ホルモン(LH)や卵胞刺激ホルモン(FSH)などの性腺刺激ホルモン(Gn)の分泌を促します。放出されたLH やFSHは、精巣や卵巣などの生殖器に作用し、男性ホルモン(アンドロゲン)や女性ホルモン(エストロゲン)の分泌を促します。アンドロゲンには、胎児期 の性分化、精子形成の促進や、雄の第二次性徴の発現等の作用があります。また、エストロゲンには、排卵の促進、子宮の発育・増殖や、雌の第二次性徴の発現 等の作用があります。アンドロゲンやエストロゲンは、ある一定量分泌されると視床下部や下垂体に作用して、GnRHやLH/FSHの分泌を調節(促進・抑 制)します(フィードバック機構)。このようにして、生殖内分泌系ではホメオスタシスが維持されています。
内分泌系は、ホルモンとよばれる情報伝達物質を、体液を媒体として各器官に届けることにより情報伝達しています。内分泌系を構成し、ホルモンを産生する器官には、下垂体、甲状腺、副腎、生殖器等があります。
ここでは、生殖内分泌系を例にして、各器官とホルモンとの関係を述べます。
生体は、外界から光や接触等の刺激を受けると間脳の視床下部から性腺刺激ホルモン放出ホルモン(GnRH)というホルモンを放出します。GnRHは、 下垂体に到達し、黄体形成ホルモン(LH)や卵胞刺激ホルモン(FSH)などの性腺刺激ホルモン(Gn)の分泌を促します。放出されたLH やFSHは、精巣や卵巣などの生殖器に作用し、男性ホルモン(アンドロゲン)や女性ホルモン(エストロゲン)の分泌を促します。アンドロゲンには、胎児期 の性分化、精子形成の促進や、雄の第二次性徴の発現等の作用があります。また、エストロゲンには、排卵の促進、子宮の発育・増殖や、雌の第二次性徴の発現 等の作用があります。アンドロゲンやエストロゲンは、ある一定量分泌されると視床下部や下垂体に作用して、GnRHやLH/FSHの分泌を調節(促進・抑 制)します(フィードバック機構)。このようにして、生殖内分泌系ではホメオスタシスが維持されています。
1-2 作用メカニズム
それでは、生体の各細胞レベルではどのようなことが起こっているのでしょうか。
分泌されたホルモンは、目的の器官に到達すると、その細胞に存在する各ホルモンに特異的な受容体と結合します。ホルモンによって、受容体が存在する場 所や情報の伝達様式が異なります。下垂体から分泌されるホルモンは、受容体が細胞膜に存在し、一方、甲状腺や精巣、卵巣等の生殖腺から分泌されるホルモン は、受容体が細胞内(核内)に存在します。
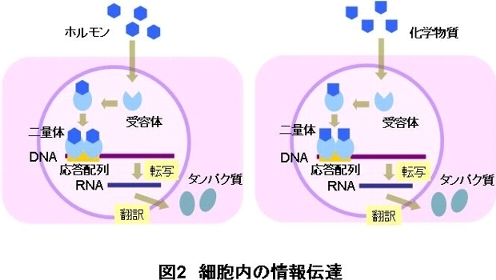
精巣や卵巣から分泌されるアンドロゲンやエストロゲン等のホルモンは、受容体に結合するとホルモン-受容体の複合体を形成します。この複合体は2つ結 合した形(受容体二量体)となり、DNAに結合します。そして、その情報はRNAへ伝わり(転写)、次の作用物質(タンパク質)の産生(翻訳)/分泌を促 します。
分泌されたホルモンは、目的の器官に到達すると、その細胞に存在する各ホルモンに特異的な受容体と結合します。ホルモンによって、受容体が存在する場 所や情報の伝達様式が異なります。下垂体から分泌されるホルモンは、受容体が細胞膜に存在し、一方、甲状腺や精巣、卵巣等の生殖腺から分泌されるホルモン は、受容体が細胞内(核内)に存在します。
精巣や卵巣から分泌されるアンドロゲンやエストロゲン等のホルモンは、受容体に結合するとホルモン-受容体の複合体を形成します。この複合体は2つ結 合した形(受容体二量体)となり、DNAに結合します。そして、その情報はRNAへ伝わり(転写)、次の作用物質(タンパク質)の産生(翻訳)/分泌を促 します。
ある種の化学物質は、構造がホルモンに類似しているため、細胞に存在する受容体と結合して情報伝達を行うことがあります。伝達された情報は、ホルモン のような作用として現れる(アゴニスト活性)場合や、ホルモンの作用を阻害する作用として現れる(アンタゴニスト活性)場合があります。それらの作用は、 ホメオスタシスによる調整範囲内であれば特に影響がみられませんが、その範囲を超えた場合には、避妊薬を多量に服用した時のように有害な影響として現れる 場合があります。
1-3 内分泌かく乱作用に関する試験法
内分泌かく乱物質とは、「内分泌系に変化を起こさせ、個体やその子孫あるいは集団に有害な影響を引き起こす外因性物質(ウエイブリッジ・ワークショッ プ1996年11月)」と定義されていますが、具体的に、ある物質が内分泌かく乱物質であるかどうかを判断するには、様々な試験を行い、その物質が内分泌 系へ作用するか、また、その作用が有害な影響であるか、という事を総合的に評価する必要があります。現状では、内分泌かく乱物質であるか否かを評価するた めの国際的に標準化された試験法(テストガイドライン)が存在しないため、暫定的な評価基準と種々の試験法の開発が国際的に行われています。以下に、経済 開発協力機構(OECD)や経済産業省等で提唱されている暫定的な評価基準を紹介します。
世の中には数多くの化学物質が存在するため、まずは、in vitro#の「受容体結合試験」、「レポーター遺伝子アッセイ」やin vivo##の「子宮増殖アッセイ」、「ハーシュバーガーアッセイ」等のスクリーニング試験によって、ホルモン様作用やホルモン阻害作用があるか否かを簡 易的に調べます。そして、スクリーニング試験によってホルモン様作用やホルモン阻害作用を持つことが疑われた物質については、次世代に影響を及ぼすかどう かをより詳しく調べるために、「子宮内・経乳汁暴露試験」や「2世代繁殖毒性試験」等の試験を行います。
# in vitro:試験管や培養器のような人工環境下での反応を検出する試験系
## in vivo:生体に直接試験物質を投与して、生体内や細胞内での反応を検出する試験系
次に、内分泌かく乱作用の評価に用いられる個々の試験法について説明します。
世の中には数多くの化学物質が存在するため、まずは、in vitro#の「受容体結合試験」、「レポーター遺伝子アッセイ」やin vivo##の「子宮増殖アッセイ」、「ハーシュバーガーアッセイ」等のスクリーニング試験によって、ホルモン様作用やホルモン阻害作用があるか否かを簡 易的に調べます。そして、スクリーニング試験によってホルモン様作用やホルモン阻害作用を持つことが疑われた物質については、次世代に影響を及ぼすかどう かをより詳しく調べるために、「子宮内・経乳汁暴露試験」や「2世代繁殖毒性試験」等の試験を行います。
# in vitro:試験管や培養器のような人工環境下での反応を検出する試験系
## in vivo:生体に直接試験物質を投与して、生体内や細胞内での反応を検出する試験系
次に、内分泌かく乱作用の評価に用いられる個々の試験法について説明します。
2. 各試験法について
2-1 受容体結合試験
受容体結合試験は、化学物質と受容体の結合のしやすさ(結合親和性)を測定する試験です。
<原理>
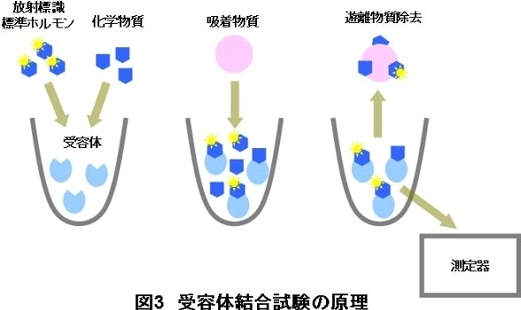
化学物質、ホルモン及び受容体が共存すると、本来であれば、ホルモンと受容体との結合が生じるところが、化学物質の受容体への結合親和性が強い場合に は、化学物質と受容体との結合が生じ、受容体からホルモンが脱離します。ここに吸着物質を添加すると、受容体と結合せずに遊離していた化学物質やホルモン は吸着物質へ吸着され、受容体に結合している化学物質やホルモンと分離することができます。ここで、ホルモンとして放射性同位体で標識した標準ホルモンを 使用し、分離した物質のうち受容体に結合している物質の放射能を測定すると、受容体に結合しているホルモンの量を測定することができ、化学物質の受容体へ の結合親和性が測定できます。
<原理>
化学物質、ホルモン及び受容体が共存すると、本来であれば、ホルモンと受容体との結合が生じるところが、化学物質の受容体への結合親和性が強い場合に は、化学物質と受容体との結合が生じ、受容体からホルモンが脱離します。ここに吸着物質を添加すると、受容体と結合せずに遊離していた化学物質やホルモン は吸着物質へ吸着され、受容体に結合している化学物質やホルモンと分離することができます。ここで、ホルモンとして放射性同位体で標識した標準ホルモンを 使用し、分離した物質のうち受容体に結合している物質の放射能を測定すると、受容体に結合しているホルモンの量を測定することができ、化学物質の受容体へ の結合親和性が測定できます。
<結果>
~評価項目(エンドポイント)~
放射標識標準ホルモンと受容体との結合を50%阻害する化学物質の濃度を算出し、IC50と定義します。今回の試験では、標準物質として天然型の女性 ホルモン(E2《エストラジオール》)又は男性ホルモン(DHT《ジヒドロテストステロン》)を使用し、標準物質のIC50値を100とした際の、標準物 質に対する化学物質の相対的な結合親和性(RBA)をエンドポイントとして公表しています。
RBA(%) = IC50(標準物質)/IC50(化学物質) × 100
~グラフ~
グラフは、化学物質の各濃度区における放射標識標準ホルモンの受容体に対する結合率(結合曲線)を表しています。グラフの縦軸は放射標識標準ホルモン と受容体との結合率を、横軸は化学物質の濃度を示しています。化学物質の受容体への結合親和性が強いほど、受容体に結合する放射標識標準ホルモンの量が減 少するため、縦軸の値は小さくなります。
化学物質と受容体との結合性が認められる場合は、化学物質の結果とともに標準物質の結果も表示しています。なお、結合性が見られない場合(「N.B.」の表示)や、結合性が小さい場合(「N.D.」の表示)は、グラフ表示を行っていません。
<結果の評価・考察>
受容体結合試験では、ホルモン様作用(アゴニスト活性)・ホルモン阻害作用(アンタゴニスト活性)の区別はつきません。しかしながら、受容体に結合し て何らかの作用を及ぼす可能性のある化学物質をスクリーニングする、あるいは、高次試験を行うための優先順位付けのためのプレスクリーニング試験として は、有用な試験系です。また、結合曲線を比較することで結合様式に関する情報を得ることができるため、化学物質あるいは受容体の構造活性相関研究への応用 も可能です。
~評価項目(エンドポイント)~
放射標識標準ホルモンと受容体との結合を50%阻害する化学物質の濃度を算出し、IC50と定義します。今回の試験では、標準物質として天然型の女性 ホルモン(E2《エストラジオール》)又は男性ホルモン(DHT《ジヒドロテストステロン》)を使用し、標準物質のIC50値を100とした際の、標準物 質に対する化学物質の相対的な結合親和性(RBA)をエンドポイントとして公表しています。
RBA(%) = IC50(標準物質)/IC50(化学物質) × 100
~グラフ~
グラフは、化学物質の各濃度区における放射標識標準ホルモンの受容体に対する結合率(結合曲線)を表しています。グラフの縦軸は放射標識標準ホルモン と受容体との結合率を、横軸は化学物質の濃度を示しています。化学物質の受容体への結合親和性が強いほど、受容体に結合する放射標識標準ホルモンの量が減 少するため、縦軸の値は小さくなります。
化学物質と受容体との結合性が認められる場合は、化学物質の結果とともに標準物質の結果も表示しています。なお、結合性が見られない場合(「N.B.」の表示)や、結合性が小さい場合(「N.D.」の表示)は、グラフ表示を行っていません。
<結果の評価・考察>
受容体結合試験では、ホルモン様作用(アゴニスト活性)・ホルモン阻害作用(アンタゴニスト活性)の区別はつきません。しかしながら、受容体に結合し て何らかの作用を及ぼす可能性のある化学物質をスクリーニングする、あるいは、高次試験を行うための優先順位付けのためのプレスクリーニング試験として は、有用な試験系です。また、結合曲線を比較することで結合様式に関する情報を得ることができるため、化学物質あるいは受容体の構造活性相関研究への応用 も可能です。
2-2 レポーター遺伝子アッセイ
レポーター遺伝子#アッセイは、化学物質が受容体に結合した後に、DNAに情報が伝えられてタンパク質を発現するかどうか(遺伝子転写活性)を測定する試験です。
<原理>
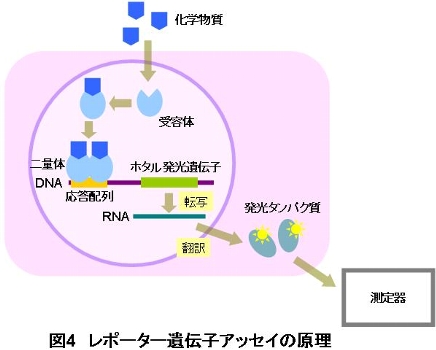
精巣や卵巣から分泌されるエストロゲンやアンドロゲン等のホルモンは、細胞内に存在する受容体と結合するとホルモン-受容体の複合体を形成します。こ の複合体は、二量体を形成して、DNAの上流に存在するホルモンに特異的な結合部位(応答配列)に結合して、その下流に存在する遺伝子の転写を活性化します。活性化された情報はRNAに伝わり(転写)、タンパク質の産生(翻訳)が促進されます(図2)。
ここで、応答配列の下流に標的遺伝子としてホタル発光遺伝子を人工的に導入すると、転写が行われた結果として、細胞から発光タンパク質が産生されるよ うになります。この発光タンパク質の発光強度を測定することによって、化学物質の転写活性能を測定することができます。化学物質の遺伝子転写活性が強いほど低濃度で発光が検出されます。
<原理>
精巣や卵巣から分泌されるエストロゲンやアンドロゲン等のホルモンは、細胞内に存在する受容体と結合するとホルモン-受容体の複合体を形成します。こ の複合体は、二量体を形成して、DNAの上流に存在するホルモンに特異的な結合部位(応答配列)に結合して、その下流に存在する遺伝子の転写を活性化します。活性化された情報はRNAに伝わり(転写)、タンパク質の産生(翻訳)が促進されます(図2)。
ここで、応答配列の下流に標的遺伝子としてホタル発光遺伝子を人工的に導入すると、転写が行われた結果として、細胞から発光タンパク質が産生されるよ うになります。この発光タンパク質の発光強度を測定することによって、化学物質の転写活性能を測定することができます。化学物質の遺伝子転写活性が強いほど低濃度で発光が検出されます。
<結果>
~評価項目(エンドポイント)~
アゴニスト活性については、天然型の女性ホルモン(E2《エストラジオール》)又は男性ホルモン(DHT《ジヒドロテストステロン》)が誘導する最大 転写活性化倍率の50%の活性を示す化学物質濃度をPC50と定義し、エンドポイントとして公表しています。また、アンタゴニスト活性については、一定量 の天然型女性ホルモン(E2《エストラジオール》)又は男性ホルモン(DHT《ジヒドロテストステロン》)を予め添加した実験系において、天然型ホルモン のホルモン活性が50%阻害される濃度をIC50と定義し、エンドポイントとして公表しています。
~グラフ~
グラフは、天然型の女性ホルモン(E2《エストラジオール》)又は男性ホルモン(DHT《ジヒドロテストステロン》)を標準物質として、標準物質の PC50値/IC50値を基に、標準物質に対する化学物質の相対的な活性(RA)を計算してグラフ化しています。グラフの縦軸は化学物質の標準物質に対す る相対活性を、横軸は化学物質の濃度を示しています。相対活性強度が100%に近いほど、その化学物質の遺伝子転写活性能が標準物質に近いことを意味しま す。
転写活性が認められる場合に、グラフの表示をしており、活性が見られない場合や活性が小さい場合(「N」の表示)は、グラフ表示を行っていません。
<結果の評価・考察>
レポーター遺伝子アッセイには、レポーター遺伝子のみを導入する方法(安定形質転換系)と、レポーター遺伝子と受容体を発現させるプラスミド##を同 時に導入する方法(一過性発現系)があります。安定形質転換系は、良好な細胞が取得できた場合には、その都度の遺伝子導入操作の必要がないため細胞の応答 性が安定しています。しかし、良好な安定形質転換細胞の作製は困難な場合があります。一方、一過性発現系は、目的の受容体を安定的に発現する適当な培養細 胞がない場合等に有効であり、発現プラスミドとレポータープラスミドの種類や組合せによりさまざまな受容体に適応することが可能です。しかし、試験の都度 遺伝子導入を行う必要があるため、安定形質転換系ほどは細胞の応答性が安定していません。
レポーター遺伝子アッセイは、ホルモン様作用(アゴニスト活性)だけでなく、ホルモン阻害作用(アンタゴニスト活性)の検出も可能です。しかしなが ら、化学物質の溶解度、細胞毒性、細胞のシグナル伝達系への影響等、受容体を介さない影響も十分に検討したうえで試験しないと、誤った結果を導く可能性が あります。また、一部の化学物質は、生体内で代謝を受けた後にホルモン様作用を示すことも知られていますが、このような物質はレポーター遺伝子アッセイで は検出が困難な場合があります。
# レポーター遺伝子:特定の遺伝子の発現を調べるための指標となる遺伝子群。ここでは、ホタル発光遺伝子のことをさす。
## プラスミド:染色体とは別に存在する小さな遺伝因子。細胞に特別な性質を付与するような遺伝子を含む。
~評価項目(エンドポイント)~
アゴニスト活性については、天然型の女性ホルモン(E2《エストラジオール》)又は男性ホルモン(DHT《ジヒドロテストステロン》)が誘導する最大 転写活性化倍率の50%の活性を示す化学物質濃度をPC50と定義し、エンドポイントとして公表しています。また、アンタゴニスト活性については、一定量 の天然型女性ホルモン(E2《エストラジオール》)又は男性ホルモン(DHT《ジヒドロテストステロン》)を予め添加した実験系において、天然型ホルモン のホルモン活性が50%阻害される濃度をIC50と定義し、エンドポイントとして公表しています。
~グラフ~
グラフは、天然型の女性ホルモン(E2《エストラジオール》)又は男性ホルモン(DHT《ジヒドロテストステロン》)を標準物質として、標準物質の PC50値/IC50値を基に、標準物質に対する化学物質の相対的な活性(RA)を計算してグラフ化しています。グラフの縦軸は化学物質の標準物質に対す る相対活性を、横軸は化学物質の濃度を示しています。相対活性強度が100%に近いほど、その化学物質の遺伝子転写活性能が標準物質に近いことを意味しま す。
転写活性が認められる場合に、グラフの表示をしており、活性が見られない場合や活性が小さい場合(「N」の表示)は、グラフ表示を行っていません。
<結果の評価・考察>
レポーター遺伝子アッセイには、レポーター遺伝子のみを導入する方法(安定形質転換系)と、レポーター遺伝子と受容体を発現させるプラスミド##を同 時に導入する方法(一過性発現系)があります。安定形質転換系は、良好な細胞が取得できた場合には、その都度の遺伝子導入操作の必要がないため細胞の応答 性が安定しています。しかし、良好な安定形質転換細胞の作製は困難な場合があります。一方、一過性発現系は、目的の受容体を安定的に発現する適当な培養細 胞がない場合等に有効であり、発現プラスミドとレポータープラスミドの種類や組合せによりさまざまな受容体に適応することが可能です。しかし、試験の都度 遺伝子導入を行う必要があるため、安定形質転換系ほどは細胞の応答性が安定していません。
レポーター遺伝子アッセイは、ホルモン様作用(アゴニスト活性)だけでなく、ホルモン阻害作用(アンタゴニスト活性)の検出も可能です。しかしなが ら、化学物質の溶解度、細胞毒性、細胞のシグナル伝達系への影響等、受容体を介さない影響も十分に検討したうえで試験しないと、誤った結果を導く可能性が あります。また、一部の化学物質は、生体内で代謝を受けた後にホルモン様作用を示すことも知られていますが、このような物質はレポーター遺伝子アッセイで は検出が困難な場合があります。
# レポーター遺伝子:特定の遺伝子の発現を調べるための指標となる遺伝子群。ここでは、ホタル発光遺伝子のことをさす。
## プラスミド:染色体とは別に存在する小さな遺伝因子。細胞に特別な性質を付与するような遺伝子を含む。
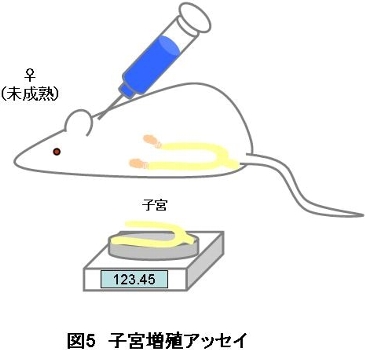
2-3 子宮増殖アッセイ
子宮増殖アッセイは、女性ホルモン(エストロゲン)の作用により、雌動物の子宮が変化(肥大)するという性質を利用して、化学物質が女性ホルモン様作用を有するか否かを検出する試験です。
<原理>
雌の卵巣から分泌されるエストロゲンは、副生殖器(子宮、膣等)へ作用して、子宮重量の変化や、子宮・膣の細胞の変化等を引き起こします(図1)。そして、ある程度エストロゲンが作用すると、フィードバック機構が働くため卵巣からのエストロゲン分泌が減少します。そこで、通常子宮増殖アッセイでは、生 体内(内因性)のエストロゲンの影響を除くために、性周期が始まる前の未成熟雌、または卵巣の摘出術を行った成熟雌のラット(またはマウス)を用いて試験 を行います。これらの雌ラットに、3日間または7日間化学物質を皮下投与または強制経口投与して、その後の子宮重量変化を測定することによってエストロゲ ン様作用を検出します。
また、内因性のエストロゲンを除いた状態のラットに、外因性のエストロゲン様物質(EE《エチニルエストラジオール》等)を加えることによって、ラットの体内のエストロゲン量を調整することができます。このラットに化学物質を投与して、その後の子宮重量の増加抑制を測定することで、抗エストロゲン様作 用を検出することができます。
<原理>
雌の卵巣から分泌されるエストロゲンは、副生殖器(子宮、膣等)へ作用して、子宮重量の変化や、子宮・膣の細胞の変化等を引き起こします(図1)。そして、ある程度エストロゲンが作用すると、フィードバック機構が働くため卵巣からのエストロゲン分泌が減少します。そこで、通常子宮増殖アッセイでは、生 体内(内因性)のエストロゲンの影響を除くために、性周期が始まる前の未成熟雌、または卵巣の摘出術を行った成熟雌のラット(またはマウス)を用いて試験 を行います。これらの雌ラットに、3日間または7日間化学物質を皮下投与または強制経口投与して、その後の子宮重量変化を測定することによってエストロゲ ン様作用を検出します。
また、内因性のエストロゲンを除いた状態のラットに、外因性のエストロゲン様物質(EE《エチニルエストラジオール》等)を加えることによって、ラットの体内のエストロゲン量を調整することができます。このラットに化学物質を投与して、その後の子宮重量の増加抑制を測定することで、抗エストロゲン様作 用を検出することができます。
<結果>
~評価項目(エンドポイント)~
化学物質を投与した群と化学物質を投与していない群(陰性対照群)の子宮重量を比較して、統計学的に有意な差が認められるかどうかを評価指標としています*。影響が認められると評価された物質は、影響の認められた最低用量を表示しています。影響が認められないと評価された物質は、「(-)」と表示して います。
* 体重や器官重量を考慮して総合的に評価しているため、例外の物質もあります。
~表~
表は、未成熟雌ラットまたは卵巣摘出成熟ラットに化学物質を投与した試験結果の表です。各用量群6匹のラットを用いています。エストロゲン様作用を検 出する系には、溶媒を投与した群(Vehicle control)を陰性対照群、EEを投与した群(Vehicle + EE)を陽性対照群として設けています。また、抗エストロゲン様作用を検出する系には、EEを投与した群(Vehicle + EE)を陰性対照群、EEと既知の抗エストロゲン様作用物質であるTMX《タモキシフェン》を投与した群(TMX + EE)を陽性対照群として設けています。
表には、各用量群(Groups)の体重(Body weight)、子宮の内腔液を含む子宮重量(Uterus wet wt.)、子宮の内腔液を除いた子宮重量(Uterus blotted wt.)が記入されています。子宮の重量は、測定した際の器官重量(絶対重量:Absolute Organ weight)と、体重に対する器官重量(相対重量:Relative Organ weight)が表示されています。
化学物質投与群と陰性対照群の器官重量を比較して、統計学的に有意な差が認められた結果には、重量の隣に印(*、**、#、##)が記されています。
詳細な条件は、各表に掲載されていますので、ご参照ください。
<結果の評価・考察>
子宮増殖アッセイは、使用動物、投与経路等、様々な試験条件があり、それぞれの条件に特徴があります。
性周期が始まる前の無処置の未成熟雌を用いる場合は、卵巣摘出術を実施する必要はなく、性周期の変化も検査する必要がありません。また、検出可能となる物質は、副生殖器に直接作用する物質以外に、視床下部や下垂体に作用して性周期開始を早める物質等も考えられます。しかし、未成熟雌の血中エストロゲン 量が低値となる期間が短く(生後20~27日位)、動物が試験に適した状態にある期間が限られているため、生後18~20日の間に化学物質の投与を開始 し、投与期間を3日間程度にする必要があります。これに対し、卵巣摘出成熟雌を用いる場合は、卵巣摘出術や、卵巣摘出が正しく行われたかどうかを確認する ための性周期検査を行う必要があります。しかしながら、化学物質の投与期間を長くすることができるため、エストロゲン様作用の弱い物質が検出できる可能性 があります。
経口投与は、消化管の吸収や肝臓での代謝が関係するため、一般的に、皮下投与と比べて感度が劣る場合があります。スクリーニング試験として子宮増殖 アッセイを利用する際には、感度を優先に置くことになるため、経口投与より皮下投与の方が適しているといえます。一方、リスク評価を行う際には、暴露形態 に合わせた投与方法(経口投与等)が適当であるといえます。
子宮増殖アッセイは、内因性のエストロゲンの影響を除いているという特殊な体内環境での試験系ですが、内分泌系に対する感受性が高まっているため、生体を利用した(in vivo)スクリーニング試験系としては有用な試験系です。
~評価項目(エンドポイント)~
化学物質を投与した群と化学物質を投与していない群(陰性対照群)の子宮重量を比較して、統計学的に有意な差が認められるかどうかを評価指標としています*。影響が認められると評価された物質は、影響の認められた最低用量を表示しています。影響が認められないと評価された物質は、「(-)」と表示して います。
* 体重や器官重量を考慮して総合的に評価しているため、例外の物質もあります。
~表~
表は、未成熟雌ラットまたは卵巣摘出成熟ラットに化学物質を投与した試験結果の表です。各用量群6匹のラットを用いています。エストロゲン様作用を検 出する系には、溶媒を投与した群(Vehicle control)を陰性対照群、EEを投与した群(Vehicle + EE)を陽性対照群として設けています。また、抗エストロゲン様作用を検出する系には、EEを投与した群(Vehicle + EE)を陰性対照群、EEと既知の抗エストロゲン様作用物質であるTMX《タモキシフェン》を投与した群(TMX + EE)を陽性対照群として設けています。
表には、各用量群(Groups)の体重(Body weight)、子宮の内腔液を含む子宮重量(Uterus wet wt.)、子宮の内腔液を除いた子宮重量(Uterus blotted wt.)が記入されています。子宮の重量は、測定した際の器官重量(絶対重量:Absolute Organ weight)と、体重に対する器官重量(相対重量:Relative Organ weight)が表示されています。
化学物質投与群と陰性対照群の器官重量を比較して、統計学的に有意な差が認められた結果には、重量の隣に印(*、**、#、##)が記されています。
詳細な条件は、各表に掲載されていますので、ご参照ください。
<結果の評価・考察>
子宮増殖アッセイは、使用動物、投与経路等、様々な試験条件があり、それぞれの条件に特徴があります。
性周期が始まる前の無処置の未成熟雌を用いる場合は、卵巣摘出術を実施する必要はなく、性周期の変化も検査する必要がありません。また、検出可能となる物質は、副生殖器に直接作用する物質以外に、視床下部や下垂体に作用して性周期開始を早める物質等も考えられます。しかし、未成熟雌の血中エストロゲン 量が低値となる期間が短く(生後20~27日位)、動物が試験に適した状態にある期間が限られているため、生後18~20日の間に化学物質の投与を開始 し、投与期間を3日間程度にする必要があります。これに対し、卵巣摘出成熟雌を用いる場合は、卵巣摘出術や、卵巣摘出が正しく行われたかどうかを確認する ための性周期検査を行う必要があります。しかしながら、化学物質の投与期間を長くすることができるため、エストロゲン様作用の弱い物質が検出できる可能性 があります。
経口投与は、消化管の吸収や肝臓での代謝が関係するため、一般的に、皮下投与と比べて感度が劣る場合があります。スクリーニング試験として子宮増殖 アッセイを利用する際には、感度を優先に置くことになるため、経口投与より皮下投与の方が適しているといえます。一方、リスク評価を行う際には、暴露形態 に合わせた投与方法(経口投与等)が適当であるといえます。
子宮増殖アッセイは、内因性のエストロゲンの影響を除いているという特殊な体内環境での試験系ですが、内分泌系に対する感受性が高まっているため、生体を利用した(in vivo)スクリーニング試験系としては有用な試験系です。
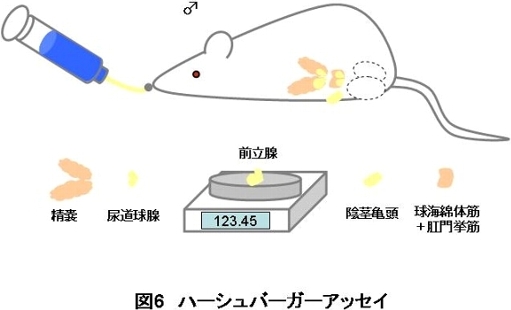
2-4 ハーシュバーガーアッセイ
ハーシュバーガーアッセイは、男性ホルモン(アンドロゲン)の作用により、雄動物の副生殖器(前立腺、精嚢等)が変化(肥大)するという性質を利用して、化学物質が男性ホルモン様作用を有するか否かを検出する試験です。
<原理>
雄の精巣から分泌されるアンドロゲンは、副生殖器へ作用して、前立腺重量の変化等を引き起こします(図1)。そして、ある程度アンドロゲンが作用する と、フィードバック機構が働くため精巣からのアンドロゲン分泌が減少します。そこで、通常ハーシュバーガーアッセイでは、生体内(内因性)のアンドロゲン の影響を除くために、精巣摘出術(去勢)を行った未成熟または成熟雄のラットを用いて試験を行います。これらの雄ラットに、7日間または10日間化学物質 を皮下投与または強制経口投与して、その後の副生殖器重量変化を測定することによってアンドロゲン様作用を検出します。
また、内因性のアンドロゲンを除いた状態のラットに、外因性のアンドロゲン様物質(TP《テストステロンプロピオネート》等)を加えることによって、 ラットの体内のアンドロゲン量を調整することができます。このラットに化学物質を投与して、その後の副生殖器重量の増加抑制を測定することで、抗アンドロ ゲン様作用を検出することができます。
<原理>
雄の精巣から分泌されるアンドロゲンは、副生殖器へ作用して、前立腺重量の変化等を引き起こします(図1)。そして、ある程度アンドロゲンが作用する と、フィードバック機構が働くため精巣からのアンドロゲン分泌が減少します。そこで、通常ハーシュバーガーアッセイでは、生体内(内因性)のアンドロゲン の影響を除くために、精巣摘出術(去勢)を行った未成熟または成熟雄のラットを用いて試験を行います。これらの雄ラットに、7日間または10日間化学物質 を皮下投与または強制経口投与して、その後の副生殖器重量変化を測定することによってアンドロゲン様作用を検出します。
また、内因性のアンドロゲンを除いた状態のラットに、外因性のアンドロゲン様物質(TP《テストステロンプロピオネート》等)を加えることによって、 ラットの体内のアンドロゲン量を調整することができます。このラットに化学物質を投与して、その後の副生殖器重量の増加抑制を測定することで、抗アンドロ ゲン様作用を検出することができます。
<結果>
~評価項目(エンドポイント)~
化学物質を投与した群と化学物質を投与していない群(陰性対照群)の副生殖器重量を比較して、統計学的に有意な差が認められるかどうかを評価指標としています*。影響が認められると評価された物質は、影響の認められた最低用量を表示しています。影響が認められないと評価された物質は、「(-)」と表示 しています。
* 体重や器官重量を考慮して総合的に評価しているため、例外の物質もあります
~表~
表は、去勢済みの雄ラットに化学物質を投与した試験結果の表です。各用量群6匹のラットを用いています。アンドロゲン様作用を検出する系には、溶媒を投与した群(Vehicle control)を陰性対照群、TPを投与した群(Vehicle + TP)を陽性対照群として設けています。また、抗エストロゲン様作用を検出する系には、TPを投与した群(Vehicle + TP)を陰性対照群、TPと既知の抗アンドロゲン様作用物質であるFT《フルタミド》を投与した群(FT + TP)を陽性対照群として設けています。
表には、各用量群(Groups)の体重(Body weight)、前立腺腹葉(Ventral prostate wt.)、精嚢(含、凝固腺)(Seminal vesicle wt.)、肛門挙筋+球海綿体筋(BC/LA wt.)、陰茎亀頭(Glans penis wt.)、及び尿道球腺(Bulbourethral gland wt.)の重量が記入されています。前立腺や精嚢等の重量は、測定した際の器官重量(絶対重量:Absolute Organ weight)と、体重に対する器官重量(相対重量:Relative Organ weight)が表示されています。
化学物質投与群と陰性対照群の器官重量を比較して、統計学的に有意な差が認められた結果には、重量の隣に印(*、**、#、##)が記されています。
詳細な条件は、各表に掲載されていますので、ご参照ください。
<結果の評価・考察>
雄は雌と異なり未成熟動物でも精巣機能が現れるため、ハーシュバーガーアッセイでは、未成熟、成熟にかかわらず去勢動物を用います。しかし、子宮増殖アッセイと同様、使用動物、投与経路等、様々な試験条件があります。以下に、使用動物に関する特徴を述べます(投与経路に関する特徴は子宮増殖アッセイの項をご参照下さい)。
未成熟雄を用いる場合は、副生殖器の発達時期である5~7週齢目に去勢を行ってから試験します。この場合は、10週齢前後の成熟雄を用いる場合に比べて副生殖器重量変化の感度が高いという特徴があります。しかし、未成熟な雄は体が成長している途中であり、副生殖器の変化以外に体重も増加しているため、 各個体の体重のばらつきが副生殖器重量のばらつきに反映してしまう傾向があります。また、器官の大きさが大きいほど正確な重量測定ができるため、成熟雄を 用いた場合のほうが安定したデータが得られやすいとの意見もあります。
ハーシュバーガーアッセイは、内因性のアンドロゲンの影響を除いているという特殊な体内環境での試験系ですが、内分泌系に対する感受性が高まっているため、生体を利用した(in vivo)スクリーニング試験系としては有用な試験系です。
~評価項目(エンドポイント)~
化学物質を投与した群と化学物質を投与していない群(陰性対照群)の副生殖器重量を比較して、統計学的に有意な差が認められるかどうかを評価指標としています*。影響が認められると評価された物質は、影響の認められた最低用量を表示しています。影響が認められないと評価された物質は、「(-)」と表示 しています。
* 体重や器官重量を考慮して総合的に評価しているため、例外の物質もあります
~表~
表は、去勢済みの雄ラットに化学物質を投与した試験結果の表です。各用量群6匹のラットを用いています。アンドロゲン様作用を検出する系には、溶媒を投与した群(Vehicle control)を陰性対照群、TPを投与した群(Vehicle + TP)を陽性対照群として設けています。また、抗エストロゲン様作用を検出する系には、TPを投与した群(Vehicle + TP)を陰性対照群、TPと既知の抗アンドロゲン様作用物質であるFT《フルタミド》を投与した群(FT + TP)を陽性対照群として設けています。
表には、各用量群(Groups)の体重(Body weight)、前立腺腹葉(Ventral prostate wt.)、精嚢(含、凝固腺)(Seminal vesicle wt.)、肛門挙筋+球海綿体筋(BC/LA wt.)、陰茎亀頭(Glans penis wt.)、及び尿道球腺(Bulbourethral gland wt.)の重量が記入されています。前立腺や精嚢等の重量は、測定した際の器官重量(絶対重量:Absolute Organ weight)と、体重に対する器官重量(相対重量:Relative Organ weight)が表示されています。
化学物質投与群と陰性対照群の器官重量を比較して、統計学的に有意な差が認められた結果には、重量の隣に印(*、**、#、##)が記されています。
詳細な条件は、各表に掲載されていますので、ご参照ください。
<結果の評価・考察>
雄は雌と異なり未成熟動物でも精巣機能が現れるため、ハーシュバーガーアッセイでは、未成熟、成熟にかかわらず去勢動物を用います。しかし、子宮増殖アッセイと同様、使用動物、投与経路等、様々な試験条件があります。以下に、使用動物に関する特徴を述べます(投与経路に関する特徴は子宮増殖アッセイの項をご参照下さい)。
未成熟雄を用いる場合は、副生殖器の発達時期である5~7週齢目に去勢を行ってから試験します。この場合は、10週齢前後の成熟雄を用いる場合に比べて副生殖器重量変化の感度が高いという特徴があります。しかし、未成熟な雄は体が成長している途中であり、副生殖器の変化以外に体重も増加しているため、 各個体の体重のばらつきが副生殖器重量のばらつきに反映してしまう傾向があります。また、器官の大きさが大きいほど正確な重量測定ができるため、成熟雄を 用いた場合のほうが安定したデータが得られやすいとの意見もあります。
ハーシュバーガーアッセイは、内因性のアンドロゲンの影響を除いているという特殊な体内環境での試験系ですが、内分泌系に対する感受性が高まっているため、生体を利用した(in vivo)スクリーニング試験系としては有用な試験系です。