メタロチオネイン
概要
メタロチオネインとは 61-68 アミノ酸残基で構成される低分子の金属結合タンパク。 植物ではこれをファイトケラチンと呼んでいる。
機能に関する知見
機能を示すメカニズム
アミノ酸配列のおよそ 1/3 がシステインで構成されており、チオール基に Zn2+、Cu2+、Cd2+ などの重金属を捕捉して金属イオンをキレート化合物に変えることで弱毒化する。 微生物の持つ金属耐性メカニズムの一つ、"細胞内での隔離"に関与し、ファイトレメディエーションへの活用が期待されている。
いずれの生物種にも見出されており、構造の特徴から 3つのクラスに分類されている。 class I と II は遺伝子にコードされているが、class III は非翻訳的に合成される。
- class I: ウマ腎臓由来 MT-1B に類似した Cys 局在を示すペプチド。哺乳類や甲殻類など動物が持っている。
-
class II: class I以外の多様なペプチドが含まれる。fungi から Cyanobacteria まで多様な生物がもつ。
バクテリアのメタロチオネインを持つのは主に Cyanobacteria と Proteobacteria。
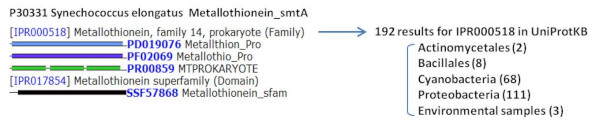
Structure of bacterial metallothionein, and taxonomic distribution of metallothionein family 14 (as of May 2013). 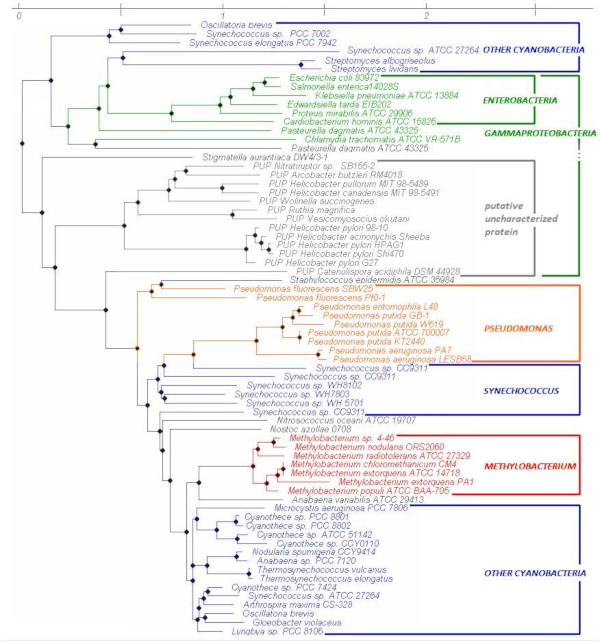
Structured phylogenetic tree of bacterial metallothioneins. --Škutková (2010) Fig 3. -
class III: gamma-glutamylcystein units で構成されるポリペプチド。植物のファイトケラチンが含まれる。
classI, IIとは異なり、直接遺伝子上にコードされておらず、非翻訳的に合成される。フィトケラチン合成酵素がグルタチオンを基質として合成する。
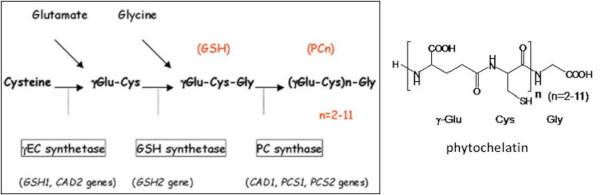
Biosynthesis of phytochelatin in higher plants. --Inouhe (2005). Fig 1. EC 2.3.2.15この酵素に対応するIPR007719
phytochelatin synthase (glutathione gamma-glutamylcysteinyltransferase)
Reaction: glutathione + [Glu(-Cys)]n-Gly = Gly + [Glu(-Cys)]n+1-Gly Phytochelatin synthase はバクテリアでも保存されおり、その中のNostoc sp. strain PCC 7120 で活性が検証されている。
Phytochelatin synthase はバクテリアでも保存されおり、その中のNostoc sp. strain PCC 7120 で活性が検証されている。
alr0975 (primitive phytochelatin synthase) は phytochelatin synthase activity を有しないが、glutathione から γ-glutamylcysteine への変換を触媒する。 toxic metal exposureへの応答性はなし、との報告。--Harada (2004).
機能を持つことが知られている生物
- class I: ウマ腎臓由来 MT-1B に類似した Cys 局在を示すタイプ。哺乳類や甲殻類など動物が持っている。
- class II: class I以外の多様なタイプ。fungi から Cyanobacteria まで多様な生物が持つ。
バクテリアのメタロチオネインは主に Cyanobacteria と Proteobacteria で保存されている。
- class III: 非翻訳的に合成されるポリペプチド。植物のファイトケラチンが代表例。
参考文献
- Robinson, N. J. et al. (2001). Microbial metallothioneins. Adv Microb Physiol. 44:183-213. PMID: 11407113

- Harada, E. et al. (2004). A cyanobacterial protein with similarity to phytochelatin synthases catalyzes the conversion of glutathione to γ-glutamylcysteine and lacks phytochelatin synthase activity. Phytochemistry. 65(24):3179-3185. PMID: 15561184

- Inouhe, M. (2005). Phytochelatins. Braz. J. Plant Physiol. 17(1):65-78.
MiFuPへのリンク
- NFUNC_0006 Metallothionein
NRULE_0009 Metallothionein
(更新日 2014/03/12)